Εισάγετε μια λέξη ή φράση σε οποιαδήποτε γλώσσα 👆
Γλώσσα:
Μετάφραση και ανάλυση λέξεων από την τεχνητή νοημοσύνη ChatGPT
Σε αυτήν τη σελίδα μπορείτε να λάβετε μια λεπτομερή ανάλυση μιας λέξης ή μιας φράσης, η οποία δημιουργήθηκε χρησιμοποιώντας το ChatGPT, την καλύτερη τεχνολογία τεχνητής νοημοσύνης μέχρι σήμερα:
- πώς χρησιμοποιείται η λέξη
- συχνότητα χρήσης
- χρησιμοποιείται πιο συχνά στον προφορικό ή γραπτό λόγο
- επιλογές μετάφρασης λέξεων
- παραδείγματα χρήσης (πολλές φράσεις με μετάφραση)
- ετυμολογία
Τι (ποιος) είναι Углерода окись - ορισμός
БЕСЦВЕТНЫЙ ТОКСИЧНЫЙ ГАЗ БЕЗ ЗАПАХА
Угарный газ; Моноксид углерода; Оксид углерода (II); Окись углерода; Моноокись углерода; Равновесие Будуара; Углерода окись; Carbon monoxide; CO; Оксид углерода(II)
Углерода окись
угарный газ CO, оксид С (II), соединение углерода с кислородом; газ без цвета и запаха. У. о. впервые выделил французский врач Ж. де Лассон в 1776 при нагревании древесного угля с окисью цинка. Плотность У. о. 0,00125 г/см3 при 0 °С и давлении 0,1 Мн/м2 (1 кгс/см2), tпл -205 °С, tkип -191,5 °С, критическая температура - 140°C, критическое давление 3,46 Мн/м2 (34,6 кгс/см2). Формально углерод в У. о. имеет степень окисления +2, однако повышенная прочность молекулы CO [энергия диссоциации 1036 кдж/моль (247 ккал/моль)] и малое межъядерное расстояние (1,128Å) заставляют предположить, что атомы кислорода и углерода связаны дополнительно донорно-акцепторной связью 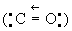 .
.
У. о. - несолеобразующий окисел, не взаимодействующий при обычных условиях с водой, кислотами и щелочами. У. о. характеризуется восстановительными свойствами и склонностью к реакциям присоединения. Так, при облучении светом и в присутствии катализаторов CO соединяется с хлором (см. Фосген); а при нагревании - с кислородом, давая двуокись CO2; с серой образует сероокись COS, с некоторыми металлами - Карбонилы металлов, например Ni (CO)4, Fe (CO)5. У. о. при повышенных температурах восстанавливает окислы металлов до свободных металлов (Fe; Pb; Ni; Cu и др.) и взаимодействует с водородом, давая, в зависимости от условий реакции, метан, смесь высших спиртов, альдегиды, кетоны.
В атмосфере У. о. содержится в незначительных количествах. Встречается в виде небольших включений в пластах каменного угля. Всегда образуется в результате сгорания углерода или его соединений при недостатке воздуха и в значительных количествах присутствует в топочных газах, выхлопных газах автомобилей (2-10 объёмных \%), табачном дыме (0,5-1 объёмных \%), являясь таким образом источником загрязнения атмосферы. Поэтому во многих странах принимаются меры по снижению концентрации У. г. в атмосферном воздухе промышленных городов (см. Охрана природы).
Получают У. о. в промышленности при взаимодействии раскалённого угля с углекислым газом: С + CO2 = 2CO или водяным паром: С + H2O = CO + H2. Таким образом производят генераторный и водяной газы, использующиеся как газообразное горючее (см. Газификация топлив). В лаборатории CO получают нагреванием при 100 °С муравьиной кислоты с серной кислотой; при этом происходит реакция: HCOOH = H2O + CO.
Применяют У. о. в химической промышленности для синтеза спиртов, углеводородов, альдегидов и органических кислот, а также для получения синтетического жидкого топлива (См. Синтетическое жидкое топливо). См. Основной органический синтез; Нефтехимический синтез.
Отравления У. о. возможны на производстве и в быту: в доменных, мартеновских, литейных цехах; при испытании двигателей, использовании топливных газов для сушки и подогрева; в химической промышленности; в гаражах; при дровяном отоплении и т.п. Поступая в организм через органы дыхания, У. о. взаимодействует с гемоглобином и образует Карбоксигемоглобин, не обладающий способностью переносить кислород к тканям. Наряду с этим уменьшается коэффициент утилизации кислорода тканями. Возникают гипокапния, затруднение диссоциации оксигемоглобина, ферментные нарушения тканевого дыхания и т.д. Защитную роль играет железо плазмы крови: его соединение с У. о. препятствует образованию карбоксигемоглобина и способствует извлечению У. о. из тканей.
При острых отравлениях наблюдается головная боль, головокружение, тошнота, рвота, слабость, одышка, учащённый пульс; возможны быстрая потеря сознания, судороги, кома (с последующим двигательным возбуждением), нарушения кровообращения и дыхания, поражение зрительного нерва и т.д.; на 2-3-й сут может развиться токсическая пневмония. Первая помощь: вынести пострадавшего на свежий воздух, растереть грудь; вдыхание паров нашатырного спирта, горячее питье. При хронических отравлениях появляются головная боль, головокружение, бессонница, возникает эмоциональная неустойчивость, ухудшаются память, внимание. Возможны органические поражения центральной нервной системы, сосудистые спазмы, повышение количества эритроцитов в крови. Профилактика: контроль за герметичностью газопроводов, состоянием местной вентиляции, удалением выхлопных газов, содержанием У. о. в воздухе рабочей зоны; аэрация зданий; соблюдение техники безопасности при взрывных работах; использование противогазов; медицинское наблюдение за рабочими соответствующих производств; в быту - правильное пользование газовыми горелками и печным отоплением.
А. А. Каспаров.
Лит.: Реми Г., Курс неорганической химии, пер. с нем., т. 1, М., 1972; Ахметов Н. С., Неорганическая химия, 2 изд., М., 1975; Тиунов Л. А., Кустов В. В., Токсикология окиси углерода, Л., 1969.
угарный газ
см. Окись углерода.
УГАРНЫЙ ГАЗ
то же, что углерода оксид.
Βικιπαίδεια
Монооксид углерода
Моноокси́д углеро́да (оксид углерода(II), о́кись углеро́да, уга́рный газ, химическая формула — CO) — химическое соединение, представляющее собой несолеобразующий оксид углерода, состоящий из одного атома кислорода и углерода.
При стандартных условиях, монооксид углерода — это бесцветный токсичный газ без вкуса и запаха, легче воздуха.
Παραδείγματα από το σώμα κειμένου για Углерода окись
1. Среди наиболее канцерогенных компонентов загрязнения ученые называют одноокись углерода, окись азота, бензол, диоксины, 1, 3-бутадиен, летучие органические частицы.
![Содержание CO в атмосфере Земли по данным [[MOPITT]] Содержание CO в атмосфере Земли по данным [[MOPITT]]](https://commons.wikimedia.org/wiki/Special:FilePath/Mopitt first year carbon monoxide.jpg?width=200)
